La degenerazione maculare legata all’età è la principale causa di perdita grave della visione nei paesi occidentali dopo i 60 anni.1,2 Insieme al glaucoma e alla retinopatia diabetica è responsabile della maggior parte dei casi di cecità e ipovisione nei paesi industrializzati. A causa dell’invecchiamento della popolazione è stato stimato che entro 10 anni il numero di persone affette da degenerazione maculare subirà un incremento del 40%, e nei prossimi 20 anni si prevede un aumento del 25% del numero dei non vedenti per questa malattia.3 A parte i costi economici enormi (in Italia l’impatto economico annuale ammonta a circa 4,4 miliardi di euro), va sottolineato l’impatto di questa malattia sulla qualità della vita delle persone che ne sono affette. Nella classifica mondiale delle patologie che causano disabilità stilata dalla Organizzazione Mondiale della Sanità (OMS) la perdita della visione è considerata comparabile al cancro, e tra qelle che più di frequente si associano ad ansietà e depressione. 4-6
L’età avanzata è il fattore di rischio principale della degenerazione maculare, mentre il fumo è il fattore di rischio ambientale più importante.7 Ruolo minore sembrano avere l’obesità, le malattie cardiovascolari, il colore chiaro dell’iride e l’ipermetropia.8 E’ stata anche riconosciuta una predisposizione familiare, con mutazioni genetiche interessanti soprattutto il sistema del complemento e i mitocondri.9 A sostegno di un ruolo centrale del complemento nella patogenesi della degenerazione maculare c’è l’identificazione di molteplici proteine del complemento nei tessuti corioretinici interessati dai processi degenerativi della malattia. A loro volta le mutazioni mitocondriali accentuerebbero la sensibilità tessutale al danno ossidativo. Il complesso fotorecettori-epitelio pigmentato retinico (EPR)-membrana di Bruch nella regione maculare è soggetto a continuo stress ossidativo che favorisce lo svilupparsi di un’infiammazione cronica coinvolgente componenti cellulari del sistema immunitario e componenti del sistema del complemento.10,11 In definitiva l’interazione di fattori genetici e ambientali, in combinazione con i normali processi di invecchiamento, condurrebbe al danno maculare con meccanismi ancoranon del tutto chiari. Nella membrana di Bruch si depositano proteine e lipidi che le fanno perdere permeabilità rendendo difficili i normali interscambi tra retina e coroide. Nelle cellule dell’EPR non più in grado di smaltire i materiali derivanti dal processo di fagocitosi dei segmenti esterni dei fotorecettori si accumula la lipofuscina che include componenti citotossiche.12 Distinti mecchanismi patologici probabilmente sono alla base delle differenti manifestazioni evolutive della degenerazione maculare. Essi convergono comunque nel comune risultato finale della morte dei fotorecettori centromaculari.
Le alterazioni cliniche precoci della degenerazione maculare, rilevabili con l’esame oftalmoscopico o biomicroscopico del fondo oculare, sono le drusen, accumuli abnormi di materiale extracellulare tra EPR e membrana di Bruch. La presenza di drusen larghe (o soft, diametro >125 micron) entro 3 mm dal centro foveale caratterizza lo stadio intermedio della malattia. Le drusen soft aumentano progressivamente in numero e dimensioni, e confluendo possono dar luogo a rilievi dell’EPR definiti distacchi drusenoidi dell’EPR. Accumuli di detriti extracellulari si formano anche tra i processi apicali dell’EPR e i segmenti esterni dei fotorecettori dando luogo alle pseudodrusen reticolari.13 Con l’accentuarsi di queste lesioni, e delle associate alterazioni pigmentarie, aumenta progressivamente il rischio di insorgenza di una neovascolarizzazione per l’aumentata produzione di vascular endothelial growth factor (VEGF) da parte dell’EPR. I neovasi, originanti dalla coroide, possono svilupparsi sotto l’EPR (tipo 1), sotto il neuroepitelio retinico (tipo 2) o all’interno della retina (tipo 3) associandosi a essudazione e emorragia, e trasformando quella che era una forma secca in forma umida (o essudativa o neovascolare) didegenerazione maculare. Le cellule dell’EPR adiacenti alle drusen vanno progressivamente incontro ad un processo di atrofia (atrofia geografica) che coinvolge la coriocapillare e i fotorecettori nelle stesse aree. Neovascolarizzazione coroideale e atrofia geografica caratterizzano lo stadio avanzato della degenerazione maculare e si associano a perdita grave della visione centrale. Il danno funzionale ha generalmente una evoluzione lenta nella forma di tipo atrofico, rapidamente progressiva nella forma neovascolare.13,
Imaging
Le alterazioni istopatologiche della degenerazione maculare coinvolgono la retina, l’EPR, la membrana di Bruch e la coriocapillare. Le tecnologie di imaging maculare di cui attualmente disponiamo consentono una precoce rilevazione e caratterizzazione di queste alterazioni. L’eccessiva lipofuscina che si accumula nelle cellule dell’EPR, e che ha un ruolo importante nell’insorgenza dell’atrofia geografica, emette una fluorescenza spontanea se eccitata da luce di breve lunghezza d’onda. Su questo fenomeno biofisico si basa l’esame retinografico della macula definito “fundus autoflurescence” (FAF).15 Nella degenerazione maculare di tipo secco/atrofico la FAF può evidenziare aree di aumentata, ridotta o assente autofluorescenza che rispecchiano le condizioni fisiopatologiche dell’EPR e dei sovrastanti fotorecettori.
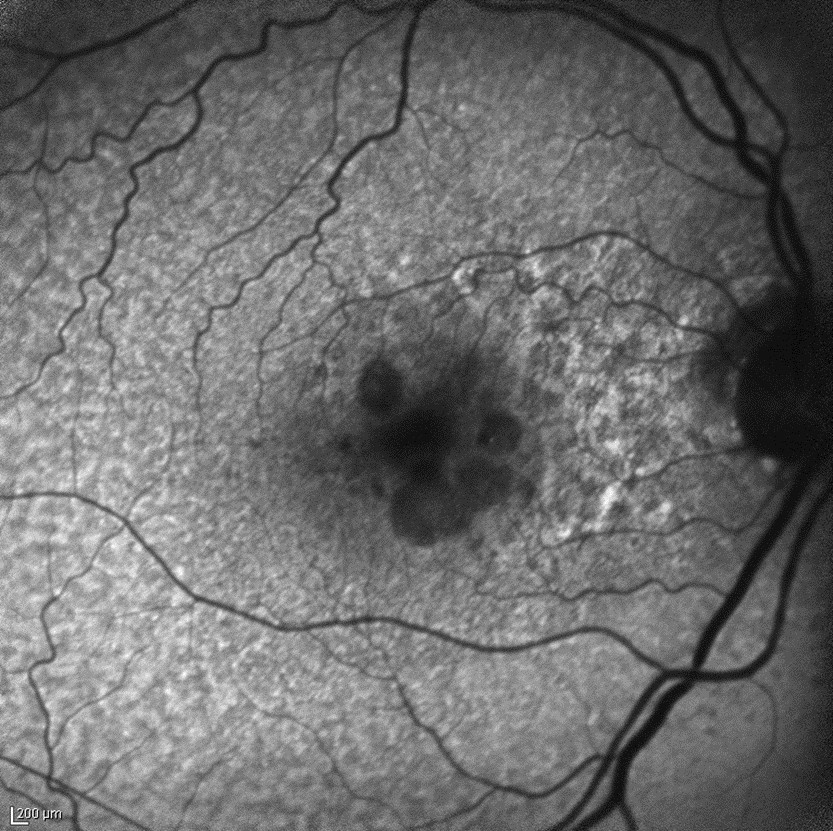
Esame in autofluorescenza in degenerazione maculare secca con atrofia geografica
La tomografia ottica a luce coerente (OCT) utilizza la luce riflessa dal tessuto retinico e dalle strutture adiacenti per creare delle immagini trasversali e tridimensionali della macula di qualità quasi istologica. Fluido sottoretinico e intraretinico, drusen, neovasi, alterazioni dei segmanti esterni dei fotorecettori, dell’EPR e della coroide vengono evidenziati in immagini ad alta risoluzione che costituiscono attualmente il gold standard per le decisioni terapeutiche nella DMLE neovascolare.13,16 La tecnologia OCT ha portato di recente allo sviluppo di un imaging angiografico (angiografia OCT) della vascolarizzazione retinica e coroideale che non necessita dell’iniezione di coloranti o mezzi di contrasto. Partendo da un’immagine tomografica, grazie ad un nuovo algoritmo di analisi, si è in grado di rilevare tutto ciò che è in movimento (cellule ematiche intravasali) in un blocco tridimensionale di tessuto corioretinico, ottenendo una immediata delineazione della rete vascolare in diversi livelli di segmentazione. Nell’imaging diagnostico della degenerazione maculare questa metodica mostra di avere notevoli vantaggi rispetto ai tradizionali esami angiografici della retina (fluorangiografia) e della coroide (angiografia con verde di indocianina). Oltre ad essere di semplice e rapida esecuzione, consente una più chiara delineazione e localizazione dei vasi neoformati. Neovascolarizzazioni precedentemente classificate come “occulte” sulla base dell’imaging angiografico classico con l’angiografia OCT diventano ben visibili e definite. Distacchi dell’EPR apparentemente non vascolarizzati mostrano all’interno la presenza di fini reti microvascolari.17 Con questa nuova tecnologia risultano inoltre evidenti i rapporti della membrana neovascolare con le strutture adiacenti (EPR, fotorecettori), consentendo una migliore caratterizzazione delle lesioni che è rilevante per la prognosi e la scelta della strategia terapeutica.
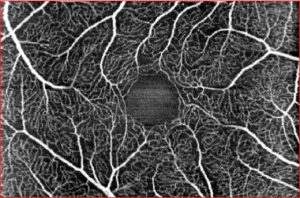
Angiografia OCT del plesso vascolare retinico superficiale in soggetto normale
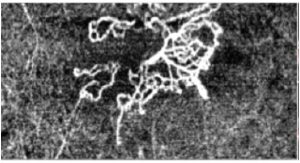
neovascolarizzazione coroideale in degenerazione maculare
Trattamento
Negli ultimi dieci anni il trattammento della degenerazione maculare è stato rivoluzionato con l’introduzione degli inibitori del VEGF, il mediatore chiave dell’angiogenesi e della permeabilità vasale.18,19 Con i farmaci anti-VEGF (pegaptanib, ranibizumab, bevacizumab, aflibercept) somministrati per via intravitreale più del 90% dei pazienti con degenerazione maculare di tipo neovascolare evita perdite della visione, e un terzo mantiene una visione di 20/40 o più.13
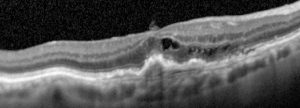
OCT in degenerazione maculare neovascolare prima dell’iniezione intravitreale di Aflibercept
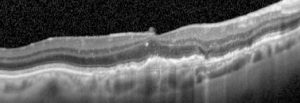
OCT in degenerazione maculare neovascolare dopo l’iniezione intravitreale di Aflibercept
La neovascolarizzazione però rappresenta solo uno degli stadi avanzati del processo patologico della degenerazione maculare. Scarse possibilità abbiamo al momento di contrastare la progressione dell’atrofia geografica e il grave danno della visione centrale che essa comporta. Il trattamento della degenerazione maculare atrofica è la nuova frontiera della ricerca. Si studiano terapie mirate ai fattori coinvolti precocemente nella patogenesi della malattia. Diversi farmaci attualmente sperimentati hanno come target l’infiammazione e il sistema del complemento che sulla base dei dati sia genetici che istopatologici sembrano avere un ruolo chiave nella patogenesi delladegenerazione maculare.14 E’ in fase III di sperimentazione il Lampalizumab (frammento di anticorpo monoclonale contro il fattore D del complemento) di cui si valuta l’efficacia nel ridurre la progressione dell’atrofia geografica. Altri farmaci sono oggetto di studio per la loro capacità di interferire nel ciclo visivo dei fotorecettori riducendo l’accumulo di A2E, componente citotossica della lipofuscina, nelle cellule dell’EPR. Un ulteriore approccio terapeutico prende in considerazione agenti neuroprotettivi al fine di prevenire la morte cellulare indipendentemente dall’evento iniziale. Infine per l’atrofia geografica conclamata con cecità centrale si studiano da tempo strategie rigenerative che utilizzano cellule staminali.14,20 Nell’attesa di nuovi ausili terapeutici non è da trascurare l’importanza dell’assunzione di sostanze antiossidanti per ridurre il rischio di evoluzione grave nella degenerazione maculare di tipo secco, mentre nelle forme più avanzate è da considerare una riabilitazione visiva al fine di utilizzare al meglio il residuo visivo.
La ricerca nel campo della degenerazione maculare si sta in questi anni sempre più avvicinando alla comprensione dei fattori che sono alla base della malattia e che ne modulano la progressione. Il riconoscimento di questi fattori, insieme a una migliore caratterizzazione dei fenotipi attraverso le nuove tecnologie di imaging, consentirà di identificare target terapeutici migliori e di attuare interventi personalizzati nella eterogenea popolazione dei pazienti con DMLE.
Bibliografia
- Friedman DS, O’Colmain BJ, Munoz B, et al: Prevalence of age-related macular degeneration in the United States. Arch Ophthalmol 2004;122:564–572.
- Prokofyeva E, Zrenner E: Epidemiology of major eye diseases leading to blindness in Europe: a literature review. Ophthalmic Res 2012;47:171–188.
- Klein R, Klein BE, Knudtson MD, Meuer SM, Swift M, Gangnon RE: Fifteen-year cumulative incidence of age-related macular degeneration: the Beaver Dam Eye Study. Ophthalmology 2007;114: 253–262.
- Augustin A, Sahel JA, Bandello F, et al: Anxiety and depression prevalence rates in age-related macular degeneration. Invest Ophthalmol Vis Sci 2007;48: 1498–1503
- Brody BL, Gamst AC, Williams RA, et al: Depression, visual acuity, comorbidity, and disability associated with age-relat- ed macular degeneration. Ophthalmology 2001;108:1893–1900
- Berman K, Brodaty H: Psychosocial effects of age-related macular degeneration. Int Psychogeriatr 2006;18:415– 428.
- Smith W, Assink J, Klein R, et al: Risk factors for age-related macular degeneration: pooled findings from three continents. Ophthalmology 2001;108:697–704.
- Vingerling JR, Klaver CC, Hofman A, de Jong PT: Epidemiology of age-related maculopathy. Epidemiol Rev 1995;17: 347–360.
- Anderson DH, Radeke MJ, Gallo NB, et al. The pivotal role of the complement system in aging and age-related macular degeneration: hypothesis re-visited. Prog Retin Eye Res 2010; 29(2):95–112.
- Barouch FC, Miller JW. The role of inflammation and infection in age-related macular degeneration. Int Ophthalmol Clin 2007;47(2):185–197.
- Hageman GS, Luthert PJ, Victor Chong NH, Johnson LV, Anderson DH, Mullins RF. An integrated hypothesis that considers drusen as biomarkers of immune-mediated processes at the RPE-Bruch’s membrane interface in aging and age-related macular degeneration. Prog Retin Eye Res 2001;20(6):705–732.
- Hogan MJ. Role of the retinal pigment epithelium in macular disease. Trans Am Acad Ophthalmol Otolaryngol 1972;76(1):64–80.
- Zarbin MA, Casaroli-Marano RP, Rosenfeld PJ. Age-rellated macular degeneration: clinical findings, Histopathology and imaging techniques. In: Casaroli-Marano RP, Zarbin MA (eds): Cell-Based Therapy for Retinal Degenerative Disease. Dev Ophthalmol. Basel, Karger, 2014;53:1–32
- Miller JW. Age-related macular degeneration revisited-piecing the puzzle: The LXIX Edward Jackson Memorial Leture. Am J Ophthalmol 2013;155:1–35
- Delori FC, Dorey CK, Staurenghi G, Arend O, Goger DG, Weiter JJ: In vivo fluorescence of the ocular fundus ex- hibits retinal pigment epithelium lipo- fuscin characteristics. Invest Ophthal- mol Vis Sci 1995;36:718–729.
- Costa RA, Skaf M, Melo LA Jr, et al: Retinal assessment using optical coherence tomography. Prog Retin Eye Res 2006;25:325–353.
- Coscas GJ, Lupidi M, Coscas F, et al. Optical coherence tomography angiography versus traditional multimodal imaging in assessing the activity of exudative age-related macular degeneration: a new diagnostic challenge. Retina 2015; 35(11):2219-222818.
- Gragoudas ES, Adamis AP, Cunningham ET Jr, Feinsod M, Guyer DR. Pegaptanib for neovascular age- related macular degeneration. N Engl J Med 2004; 351(27):2805–2816.
- Rosenfeld PJ, Brown DM, Heier JS, et al. Ranibizumab for neovascular age-related macular degeneration. N Engl J Med 2006;355(14):1419–1431.
- Miller JW. Beyond VEGF – The Weisenfeld lecture. Invest Ophthalmol Vis Sci 2016;57:6911-6918.